열려있는 정책플랫폼 |
국가미래연구원은 폭 넓은 주제를 깊은 통찰력으로 다룹니다
※ 여기에 실린 글은 필자 개인의 의견이며 국가미래연구원(IFS)의 공식입장과는 차이가 있을 수 있습니다.
관련링크
본문
인간 유전체 해독은 2003년 13년간 38억 US$란 막대한 비용으로 인간유전체 분석을 완료함에 따라 유전체(Genome) 시대를 열게 되었다. 많은 생물 종 유전체가 분석되었고 유전체 정보에 따라 수많은 기능을 가진 단백질들(단백체, Proteomics) 만들어졌다. 단백질의 기능을 활용하여 인체는 무수한 생리활성 물질들(대사체, Metabolomic)에 대한 기초 연구 결과가 쏟아져 나왔고 이를 응용한 의·약학, 식품, 화학, 환경 등 산업들에 활용되면서 포스트 게놈(Post Genome) 시대로 발전하였다.
인체 내에 일어나는 다양한 생명현상을 유전체, 단백체, 대사체로 충분히 밝힐 수 있을 것이라는 20세기 후반 기대는 예상과 다르게 충분히 만족스러운 결과는 얻지 못했다. 그 이유는 유전체가 생물의 번식, 성장을 만드는 설계도이지만, 어떤 생물도 완전히 독립적으로 살 수 없고, 다른 생물들과 함께 생태계를 만들고 있어 생물간 연관관계는 매우 중요한데 이점을 간과하였기 때문이다. 좀 더 정확한 생명현상을 알기 위해서는 특정 생물 유전체도 물론 중요하지만, 생태계 가족 생물들 가족들의 유전체, 단백체, 대사체간의 상관관계 연구가 더욱 필요하였다.
매우 작아서 맨눈으로는 볼 수도 없는 미생물들은 지구생태계 족보(Phylogenic tree, 系統樹)상에서 보면 대부분을 차지하는 가장 큰 집단인 데 비해, 인간을 포함한 동식물은 사실 계통도의 가장 말단 잔가지에 있어서 상관관계 분석 시 미생물 기능분석은 매우 중요하다. 미생물이 사람의 입, 코, 손발, 창자 등 특정 영역에 서식하고 있는 미생물 집단을 Microbiota라 명명하고 인체 전체 Microbiota를 합해서 이루는 생태계를 인체 Microbiome이라 한다.
Microbiome은 Microbe(미생물)과 Bim(생물군계)의 합성어로 인체 Microbiome은 인간과 함께 살아가는 미생물을 포함한 다른 생물의 총 생태계로 사람과 함께 살아가는 생물체의 유전체에서 비롯된 유전자, 단백질, 대사물들의 상관관계 전체를 표현한다.
즉, Microbiome 연구는 생태계 내의 생물들 간의 상호작용을 연구하여 생태계의 전체 생명현상을 밝히는 것이다. 인간 Microbiome 연구를 통해서 지금까지 알지 못했던 많은 새로운 과학적 사실과 인체 연구로만 도저히 밝힐 수 없었던 많은 과학지식이 속속 밝혀지고 있다.
Microbiome에 대한 연구논문 발표 건수를 보면 2001년에 불과 74편/년이 발표되었는데, 2006년 332편, 2011년 1,791편, 2016년 7,904편, 2020년 12,113편/년 발표되어 최근 9년 사이에 무려 약 670% 이상 증가하고 있고 특허출원도 급격한 증가 추세를 보여주고 있어 학문적/ 산업적 분야에 Microbiome 중요성을 대변하고 있다.
<인체 Microbiome 응용연구의 시작>
인체 Microbiome은 Microbiome이란 용어를 사용하기 이전부터 건강에 문제가 있는 사람 장내 대변을 건강한 사람의 대변으로 바꾸어 건강을 되찾는 대변이식(Fecal Microbiota Transplantation, FMT)에서 시작되었다. 대변에는 수많은 종류의 미생물들이 동시에 증식되고 있는 큰 반응기와 같이 천문학적 수의 미생물 종이 함께 살면서 인체 건강에 중요한 역할을 하고 있다.
FMT는 장내 사는 수많은 미생물과 미생물 유전체, 단백체 및 대사체가 동시에 이식되어 인체 건강과 질병을 치유하기 위해 사용하였기 때문에 Microbiome 기술을 원조로 여긴다.
난치성 장염((Inflammatory Bowel Disease, IBD), 원인균: Clostridium difficile)에 걸리어 어떤 항생제로도 치료가 어려운 환자에게 건강한 정상 대변을 이식하면 장염 완치율이 90%에 이르렀다는 Thomas Borody박사(호주 소화기질환 센터)와 Alexander Khoruts교수(미국 미네소타 의대)의 결과가 전문학술지 (Nature Reviews Gastroenterology & Hepatology(2011))에 발표하면서 정식으로 학계에 등단하였다.
물론 대변 이식을 병 치료에 사용한 예는 중국에서도 4세기 동진 시대에 “신선전”의 저자인 갈홍(Ge Hong)이 인분을 치료에 사용한 예도 있고, 조선왕조실록에는 중종의 열병이 심할 때 감초를 넣은 대나무 통을 화장실에 넣어 대변이 스며들게 한 후 말린 야인건수(野人乾水)를 사용한 예는 대변 미생물을 치료에 이용한 좋은 예이다.
17세기 Hieronnymus Fabricius(이탈리아)가 동물 분변을 질병이 있는 동물에게 먹여서 치료한 예(박광균, 2021)도 있다. 인체 Microbiome과 질병과 연관되었다는 연구 시작은 정상인과 당뇨병 환자의 장내 Microbiome을 비교한 Nature 지(Qin et al, 2012) 연구 결과가 주목을 받으면서 활성화되었다.
미생물 생태계인 Microbiome을 구성하는 다양한 종류의 미생물 분포와 숫자뿐만 아니라 구조 및 기능의 연관관계 등이 당뇨병 환자와 정상인이 큰 차이를 보인다는 중요한 결과를 얻어서 질병과 Microbiome은 깊은 연관관계가 있다는 결론에 도달하였다.
나아가 Walker & Parkhill et al. 이 발표된 Science 지(2013)와 Cell 지(2014) 에서는 미생물이 전혀 없는 무균의 쌍둥이 생쥐를 이용하여 쌍둥이 중 한 마리에는 비만한 사람의 장내 분변을 대변에 이식하였더니 비만한 어른 생쥐로 성장하였고, 또, 다른 한 마리 쌍둥이에는 마른 사람의 분변을 대변 이식하여 야위고 마른 생쥐가 되는 것을 발견하였다.
같은 방법으로 비만한 사람의 분변을 집어넣은 생쥐에게 다이어트(Diet)식인 저지방 고섬유질의 사료를 먹여도 역시 비만해지는 것을 발견하였고 특히, 비만한 생쥐와 마른 생쥐의 분변을 바꾸면 비만했던 쥐는 야위고, 마른 생쥐는 비만해졌다. 지금까지는 비만해지는 이유가 고에너지, 저 섬유질의 음식 섭취에 있다고 생각했는데, 그렇지 않고 분변에 살아 있는 Microbiome 때문에 생쥐가 비만해진다는 놀라운 결과를 발견한 것이다.
이런 결과로 이제 장관 내는 물론이고 장관과 관계가 없을 듯 한 심장, 혈액, 뇌신경 등 인체 내 어떤 위치에도 Microbiome이 건강/질병에 영향을 미칠 수 있다는 결론을 얻었다. 대변 이식은 건강한 대변을 모두 바꾸어 넣기 때문에 현실적으로 대변에 있는 수없이 많은 개개의 미생물을 인위적으로 조절하여 비만 문제를 해결하기는 매우 어렵다고 생각했는데, Christensenella minuta라는 미생물을 대변에 혼합하여 대변 이식을 하였더니 비만한 생쥐가 다시 마른 생쥐가 되었다.
거의 재현하거나 반복하기 어려운 힘든 수많은 미생물종이 천문학적 수가 포함된 Microbiome 전체가 아니라 이 경우는 1, 2가지의 미생물종으로도 충분히 비만 문제를 해결할 수 있다는 놀라운 가능성을 보여 주었다.
인간의 경우 30억 염기쌍의 유전체를 가지고 있고 생리 활성을 가진 기능성 단백질 수는 약 2만 개 정도로 보고되고 있다. 사람의 전체 세포 수는 정확한 숫자는 보고마다 다르지만 대략 약 50조-60조 정도로 보고 있는데, 사람과 함께하는 인체 Microbiome의 미생물 종류는 약 6,000종에 총 숫자도 사람 세포 수의 10배 이상이라고 추정하고 있다. 인체 Microbiome의 가지고 있는 기능 단백질 수는 700만 개 이상으로 사람이 가지는 단백질에 약 350배 정도의 단백질을 가지고 있다고 추정한다.
인간 Microbiome이 가지고 있는 단백질의 수가 인간의 단백질보다 350배 이상 많아서 사람이 분해/합성/전환하지 못하는 물질도 인간 Microbiome의 단백질 힘을 빌리면 얼마든지 가능하다. 실제로 인간이 만들 수 없는 비타민과 같은 많은 생리활성 물질들을 얼마든지 장내미생물이 합성할 수도 있고, 내장 내에 들어온 독성물질도 얼마든지 무독화시킬 수 있는 이유이다. 생쥐가 에너지원으로 사용하기 어려운 다이어트 식품인 저 지방, 고섬유질을 먹어도 비만해지는 것은 생쥐 자체는 그런 식품을 분해하거나 합성하지 할 수 없지만, 생쥐 장내 Microbiome이 가진 수없이 많은 단백질 기능 중에는 얼마든지 고섬유질을 분해하거나 지방질을 합성할 수 있어서 결국, 고에너지의 식품을 먹은 것과 같은 효과로 비만해지는 것이다.
정상적인 장(腸) 상피는 인간에 필요한 물질만 능동적 수송(Active transport)하는데, ‘어떻게 장내 Microbiome이 만든 인체가 원치 않는 물질들도 장 상피를 통과할 수 있을까?’라는 의문이 생긴다. 정상적인 장 상피의 외부에는 <아래 그림>에서 보듯이 inner Mucose layer와 outer Mucose layer라는 2개의 장애물(Barrier)이 있어 마치 적의 공격을 막기 위한 성곽 외부에 1차, 2차 장애물 벽으로 성안에 사는 국민을 보호하고 있는 것과 비슷하다.
정상적인 상태에서는 inner Mucose layer에는 항체(Antibody)가 분비되어 해로운 병원균, 독소 물질 등의 접근을 막고 있을 뿐만 아니라 장 상피세포에서는 필요하면 항생 펩타이드를 만들어 분비하여 병원성 균을 막아주고 있다. 두 개의 방어벽과 항체와 항균 펩타이드 공격을 무사히 통과한 바이러스나 병원균이 있다하더라도 상피세포 내에 있는 대식세포(Mycrophage)가 식균 작용(Phagocytosis)하면서 보호하여 정상적인 장내 외 정상상태를 유지(Int.J.Mol. Sci.(2016)하고 있다.
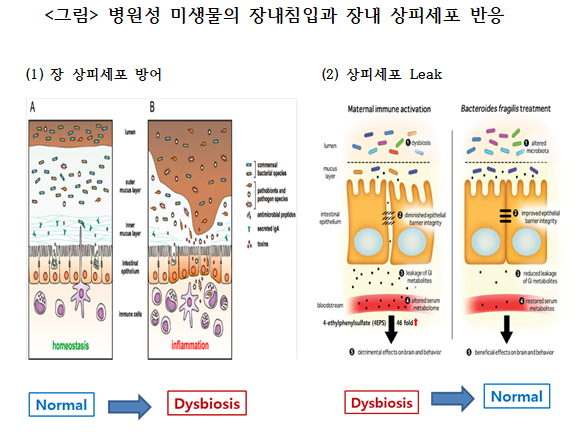

하지만, 나쁜 Microbiome에서 유래된 알코올, 항생제, 독소, 병원균, 스트레스 등의 영향을 받으면 inner와 outer Mucose layer가 파괴되면서 장 상피세포 간 틈(Cell(2013))이 생겨 장 누수 증후군(Leaky gut syndrome)이 발생하고, 벌어진 틈을 통해서 세균이나 고분자물질이 들어오면 대식세포의 작용으로 염증이 생기고 TNFα등 사이토카인이 혈액 내로 분비되고, 장내 저분자 물질도 아무런 저항 없이 수동적으로 곧장 혈관으로 유입되면 혈행을 따라 전신에 퍼질 수 있다. 이러한 장내 Microbiome의 심각한 변화는 인체 내에 있는 간, 심장, 뇌신경 등 어떤 기관에도 영향을 미칠 수 있는 이유가 된다.
상금이 노벨상의 3배(32억 원)에 달하고 기초물리학, 생명공학, 수학 등 3개 분야에 상이 주어지는 과학의 아카데미상으로 불리는 ‘Breakthrough Prize’가 있다. 뇌와 장내 Microbiome 관계 연구 성과로 2020년에 이 상을 받은 Jeffrey M. Fredman의 연구 업적을 아래와 같이 소개한다.
즉, 비만 Microbiome은 SCFA(Short Chain Fatty Acid)를 극소량 만들어 장 상피로 유입되는 양이 적어지면 Serotonin, Norephinephrine 생산/조절이 어려워지고, Lipolysis cytokine 농도가 증가하고, Endotoxin양이 증가로 염증이 발생하여 최종 장내 Gluconeogenesis 떨어지면서 뇌에 에너지원인 Glucose이 낮아져서 계속 적인 탄수화물 식사를 뇌가 요구하여 사람은 비만해진다.
또한, 혈액 내 Glucose 양은 떨어지지만 실제로는 간에 System Glucose함량이 높아지면 인슐린 내성(Insulin tolerence)이 생겨 결국 비만을 더욱 촉진되어 최종적으로 제2형 당뇨병이 걸릴 확률이 높아진다고 설명하고 있다, 반대로 비만을 유도하지 않는 Microbiome은 SCFA의 장 상피투과를 높여서 비만 Microbiome 경우의 비만한 경우와 반대 현상이 생기고 더욱이 식욕억제 호르몬인 Leptin을 분비하여 뇌에서 식욕을 억제하여 인슐린 민감성(Insulin sensitivity)을 올려주어 건강한 상태를 유지할 수 있게 한다.
실제로 장내 microbiota와 Gut-Brain Axis를 통한 뇌의 Neuroinflammartion 상관관계를 발표(Cheng liu et al. (2022))하였고 Microbiome의 생산한 SCFA의 중요성을 설명하였다. 최종적으로 마이크로바이옴이 소화기관 내의 질병뿐만 아니라 신체 내의 모든 질병에도 관여할 가능성을 설명한 것이다.
<인체 Microbiome과 정밀 의료 >
한국인 부부 과학자(허준열, 글로리아 최)가 자폐증의 원인과 대책을 밝히는 2편의 연구논문을 최근 Nature지(2017)에 발표했다. 임신 중인 생쥐에 바이러스를 인위적으로 감염시키면 태어나는 생쥐새끼는 당연히 자폐증 생쥐가 된다. 이때 바이러스에 감염된 생쥐 장내 Microbiome에 사는 미생물을 항생제로 모두 사멸시키면, 신통하게 태어난 생쥐가 자폐증에 걸리지 않는다는 재미난 결과를 발표하였다.
바이러스에 감염된 생쥐는 뇌의 S1DZ 영역에 바이러스 감염 시 만들어진 면역 세포가 쌓이게 되면, 뇌 영역 중 반복 행동이나 사회성이 결여 유발 지역으로 신호가 전달/자극하여 결국 어린 생쥐는 자폐증이 걸린다고 밝혔다.
반대로 항생제로 장내 Microbiome에 있는 미생물들을 완전히 없애 버리면 뇌 영역에 흡착되는 면역 세포가 줄어들면서 뇌 영역 중 사회성 결여나 반복 행동 부위로 신호 전달을 차단하여 태어난 생쥐가 자폐증이 걸리지 않는다고 놀라운 발표를 하였다.
또한 Microbiome 중 모든 미생물이 아니라 특정한 미생물만 없애더라도 자폐증이 걸리지 않는다는 결과는 Microbiome 신약 개발을 기대할 수 있게 하였다. 같은 해 미국 미네소타 대에서는 항생제로 장세척을 한 자폐증 환자에게 건전한 사람의 대변을 이식하면 위 장관 80% 개선, 수면 습관과 사회적 skill 개선되면서 자폐증이 개선된다는 결과를 Microbiome 지(2017)에 발표하였다.
결국 신생아의 자폐증도 Microbiome과 밀접한 관계가 있고 자폐증 환자의 치료도 더 많은 연구를 하면 Microbiome이 실마리를 제공할 것으로 추정하고 있다. 알츠하이머 환자와 일반 건강인의 장내 Microbiome을 비교하면 알츠하이머 환자의 경우는 Microbiome의 다양성이 현저히 떨어지고 Firmicutes 속 미생물의 상대적 비중이 현저히 감소되면서 Bacteroides 속 비중은 올라가는 현상(Scientific Reports(2017))을 발표하였다.
특히, 마이크로바이옴을 형성하는 장내미생물의 종류에 따라서 면역반응의 변화와 CNS (Cerebral Neurological System) 영향을 밝힌 논문(Nature neuroscience(2017))도 역시 발표되었다. 암 치료는 현재 1세대 화학 항암제, 2세대 표적 항암제에 이어 3세대 면역 항암제가 사용되고 있다. 최종 치료제로는 면역 항암제를 사용하는데, 암세포가 T cell의 PD-1 위치를 잡으면 T cell이 작용하지 못하여 암세포 증식을 막을 수 없게 하는 것이 항암제의 큰 약점이었다.
하지만 면역 항암제는 T 세포의 PD-1에 암세포의 결합은 막는 항체와 같은 blockade를 사용하여 T 세포가 암세포의 방해 없이 암세포를 죽이는 획기적인 치료 방법이다. 하지만, 초고가의 면역 항암제로도 잘 치료되지 않는 경우가 많았는데, Microbiome 기술로 해결할 수 있는 실 머리(Science(2018))를 찾았다. 즉, 암세포를 감염시킨 생쥐에 면역 항암제 PD-1 blockade를 사용할 때 장내 Microbiome 중에 Bacteroides 균총이 많은 쥐는 helper cytokine인 CD4Trel 가 작동하여 암세포가 크게 줄어들지 않아 나쁜 항암 치료 결과를 얻었고, Bifidobacterium, Akkermancia, Faecalibacterium과 같은 균총이 많은 Microbiome 보유 생쥐는 Killer 세포인 CD8T cell이 작용하여 항암효과가 크다는 결과를 얻었다.
장내 Microbiome의 조절로 개인 맞춤형 정밀 의료 (Precision medicine)를 할 수 있다는 가능성을 보여 준 것이다.
질병 치료 시 Microbiome의 조절은 항생제를 사용하여 완전히 Microbiome 자체를 모두 죽이고 건강한 대변 이식을 하는 방법은 언제든지 충분히 가능은 하지만 항생제 부작용 등 다른 부작용이 있을 수 있어서 장내 Microbiome 중 원치 않는 장내미생물만을 선택적으로 죽이는 방법도 개발되고 있다. 최근, EpiBiome 사(미국), Biomx 사(이스라엘), Eligo Bioscience 사(프랑스)에서는 유전자 가위 기술(CRISPR Cas9) 이용하여 원하는 병원균을 선택적으로 죽이는 기술이 개발하였다.
이제 질병에 따른 마이크로바이옴 내 유익 및 해로운 균이 분류된다면 병원균이나 개인 건강에 장애를 일으키는 해로운 균만을 죽이는 선택적인 유전자 가위로 Microbiome의 균총을 바꾸어 치료하는 방법이 가까운 장래에 실현되어 인류의 난제 중 하나인 난치병을 맞춤형으로 예방/치료하는 날이 올 것으로 기대한다.
<인체 Microbiome 시장 >
Microbiome 연구는 비만, 당뇨, 고혈압 등 생활 질환뿐만 아니라 치매, 자폐, 주의력결핍 과잉행동 장애, 천식, 아토피, 각종 암, 심혈관, 면역/염증 등 많은 인체질병의 예측, 치료가 가능할 것으로 예측한다. 건강 기능식품 시장이 커지면서 용도와 기능에 따라 기능보조식품, 식의약품, 의료용 식품 등으로 재분류되어 전체 시장은 급격하게 확대될 것이다. 유산균을 포함한 건강식품 관련 세계 Microbiome 산업시장은 2019년 811억 달러에서 연평균 7.6%씩 증가하며 2023년 1,087억 US$(약 130조 원)로 확대될 전망이다.
2019년 기준 기술별 시장 점유율은 Prebiotcs (602억 US$)가 74.23%로 최대이며, Probiotcs (126억 US$) 15.54%, 표적 항균제 (63억 US$) 7.77%, 기타 (21억 US$) 2.59% 순이며, 산업별 시장 점유율은 식음료(747억 US$)가 92.11%로 최대이며, Healthcare (60억 US$) 7.40%, Personal care (2억 US$) 0.25%, 기타 (2억 US$) 0.25% 순으로 나타나고 있다 하지만, 순수한 Microbiome 자체 시장은 2022년 5억 US$ 달하고 향후 2025년까지 연평균 21.1%의 높은 시장성장으로 약 9억 US$의 시장이 예측(Markets and Marckets, 2017.3)하고 있다.
앞으로 신약 및 진단이 승인되는 2024년에는 진단시장이 506.3 million US$, 제약시장은 9,387.5 million US$로 급격히 성장(BCC Research, 2017)할 것으로 예상하고 각 질병 군에 대한 새로운 Microbiome 신약이 FDA 승인이 된다면 훨씬 시장 규모가 클 것으로 예측한다. Microbiome 기초 연구는 지금까지 생각하지 못하는 새로운 현상을 많이 발견할 수 있을 뿐만 아니라 인류에 미치는 파급효과가 지대하므로 앞으로 국가의 먹거리 개발 엔진이 될 수도 있어서 큰 관심을 가질 필요가 있다.
아울러 동식물과 환경에 존재하는 Microbiome 연구로는 농업, 사료, 축산 수의, 식품, 신 화학합성, 환경 등 관련 산업의 발전뿐만 아니라 최근 강조하고 있는 ESG 경영을 할 수 있어서 환경보호, 기후변화 방지 등에도 큰 역할을 할 것으로 기대한다. Microbiome은 미래 세계 경제를 주도할 것으로 예측되는 바이오경제를 달성하는 방아쇠 역할로 기대가 크고, 이를 잘 활용하여 융복합 산업을 성공적으로 형성해나간다면 충분히 새로운 시장과 일자리 창출에 큰 역할을 할 수 있을 것으로 기대한다.
<맺는말>
4차 산업혁명에서 화두가 되는 “큰 물고기가 작은 물고기를 잡아먹는 것이 아니고, 빠른 물고기가 느린 물고기를 잡아먹는다.” 라는 속도이론과도 Microbiome 연구/상용화는 잘 부합하고 있다. 맨눈으로는 도저히 볼 수도 없는 작은 미생물 군이지만 엄청나게 빠른 속도로 증식하고 있는 미생물 군집 체인 Microbiome은 작고 빠르다는 점에서 4차 산업혁명 기조와 비슷하다.
Microbiome은 자체 시장뿐만 아니라 타 산업에 엄청난 시장 파급효과가 있어 기존 의학, 약학, 농축 식품, 화학, 환경 산업 등을 신산업으로 유도하는 중요한 산업 개혁 지렛대로 작용할 것은 분명하다. 특히 미생물 산업에 강점이 있는 우리에게는 바이오경제 달성에 Microbiome 기술이 중요한 역할을 할 것으로 전망한다.
- 기사입력 2021년12월07일 17시00분
- 검색어 태그 1
댓글목록
등록된 댓글이 없습니다.
