열려있는 정책플랫폼 |
국가미래연구원은 폭 넓은 주제를 깊은 통찰력으로 다룹니다
※ 여기에 실린 글은 필자 개인의 의견이며 국가미래연구원(IFS)의 공식입장과는 차이가 있을 수 있습니다.
관련링크
본문
항생제(抗生劑)는 미생물을 죽이는 살균 활성(Bactericidal acivity)이 있는 물질과 미생물 성장을 억제하는 정균(靜菌) 활성(Bacteriostatic acivity)이 있는 물질로 구분할 수 있다.
병원균을 치료할 목적으로 1900년대에는 지금과 같은 항생제가 아닌 독성이 강한 수은(水銀)과 같은 중금속이나 비소(砒素, Arsenic)와 같은 항(抗)미생물 물질(Antimicrobial compound)을 사용하거나 화학적 처리로 독성을 순화(淳化)시켜 주로 성병(性病)을 치료할 목적으로 많이 사용하였다.
1929년 알렉산더 플레밍(Alexander Fleming)이 푸른곰팡이에서 페니실린(Penicillin) 발견을 시작으로 곰팡이나 흙 미생물인 방선균 (Streptomyces속)에서 많은 항생제를 발견하여 질병을 퇴치할 수 있게 되어서 오늘날과 같은 항생제 황금시대가 되었다.
항생제의 명칭이 흙에 많이 살아가고 있는 미생물인 방선균 중 스트렙토마이신 (Streptomycin)이란 항생제가 발견되면서 흙 미생물인 방선균의 이름을 ooo-myces로 명명하였다. 이런 연유로 미생물 이름 ooo-“myces”에 기인하여 새로 찾은 항생제 이름을 ooo-“mycin”으로 명명하여 지금은 항생제를 “mycin(마이신)”으로 사용하게 되었다.
불과 120년 이전 항생(抗生)이란 용어조차 없던 시절에는 피부에 사소한 상처가 생겨 곪게 되면 깨끗하게 세척/소독하는 것 외는 별다른 방법이 없어서 그냥 자연적으로 낫기만 기다리고 있었다. 혹시, 인체 내부에 염증이 생겨서 곪으면 인체 자체의 면역체계로 자연적으로 회복될 수도 있지만, 낫지 않으면 속수무책으로 심각한 상황이 되는 경우가 많았다.
사실, 페니실린을 개발한 Fleming도 제1차 세계대전에 외과 의사로 참전하여 수많은 부상병이 상처 부위가 곪아서 고름이 생기는 단순한 농양(膿瘍)으로 죽어가는 황당한 상황을 보면서 Fleming은 세균 병 치료에 전 생애를 바치고 마침내 페니실린을 발견하였다. 당시 농양이 생기면 외과수술로 상처 부위를 제거하고 소독하는 정도였다. 하지만 심하게 곪으면 고열이 발생하여 패혈증으로 죽게 되는데, 이때 할 수 있는 치료법은 상처 부위인 팔다리를 잘라내는 것뿐이고 팔다리를 잘라내는 무시무시한 치료(?)도 시기를 놓치면 결국 죽는 수밖에 없었다.
우리나라 조선왕조실록을 보면 제3대 태종, 제5대 문종, 제7대 세조, 제9대 성종, 제10대 연산군, 제11대 중종이 속칭 곪는 종기(腫氣) 질환에 시달렸다는 보고가 있다. 예를 들면 문종은 종기로 고생하다가 결국 39세로 승하하시었고, 사망 주원인이 종기라는 염증이라고 한다. 국가에서 가장 고귀한 신분인 왕 조차로 종기와 같은 피부병이 걸리면 속수무책임을 알 수 있다.
페니실린을 비롯한 많은 종류의 항생제로 감염된 질병에 맞게 자유롭게 치료를 할 수 있는 현대사회에서는 피부에 바르거나 먹기만 하여도 인체 내외의 염증을 깨끗이 제거할 수 있어서 “항생제를 마법의 치료사”라고 충분히 칭할만하다.
항생제(Antibiotics) 이야기를 하면 많은 사람은 1928년 Fleming이 세균 배양시험 중에 우연히 오염된 푸른곰팡이 (Penicillium notatum)가 만든 페니실린이 인간이 만든 최초의 항생제로 생각하기 쉽다. 사실 이미 오래전부터 속칭 자연 항 병원균 능력이 있는 식물껍질, 뿌리 추출물이나 특정 곰팡이를 모아서 가공하지 않고 그대로 곪는 부위에 도포 하거나 문질러 주는 방법으로 오랜 기간 치료를 하여왔다.
기원전 1500년경 중국에서는 콩을 갈아서 만든 두부에 핀 곰팡이로 상처나 곪은 종기에 발라서 상처를 치료했다고 하는데, 만약 지금의 페니실린을 만드는 곰팡이였다면 충분히 가능한 이야기이다. 또한, 최근 수단과 이집트 나일강 지역에 약 2000년 전, 존재했던 누비아(Nubia) 왕국 시대에 살던 고대 인류의 인골(人骨)이 발굴되었고, 형광현미경을 사용하여 인골을 조사한 결과, 흙 미생물에서 발견(1955년)되어 현재도 사용하고 있는 테트라사이클린 (Tetracyclin)이란 항생제 흔적이 발견(George Armelagos et al.(2010), American Journal of Physical Anthropology) 되었다고 보고되고 있다.
이런 결과로 필자가 추측하기로, 아마, 테트라사이클린을 생산하는 방선균이 많이 자라는 토양을 병을 낫게 하는“ 마법의 가루(Magic powder)”로 고대의 의사이자 무당인 주술사가 사용했을 가능성이 있다고 생각한다.
이번 원고는 왕이나 귀족조차도 엄청난 고통을 느끼면서도 큰 해결책이 없었던 곪는 병을 일으키는 화농균(化膿菌)인 포도상 구균(Staphylococcus)이나 연쇄상 구균(Streptococcus)을 단번에 치료하는 신비한 마법의 가루인 항생제에 관해 이야기를 하고자 한다.
<초기 항생제와 상용화>
유럽의 중세에는 비소(砒素, Arsenic)나 수은(水銀, Mercury)과 같은 유독한 중금속을 임질(Gonorrhea)이나 매독(Syphilis)과 같은 성병 치료제로 사용했는데, 성병 세균은 박멸할 수는 있지만, 과량으로 사용하면 중금속 중독으로 환자가 사망하기도 하였다.
항생물질 연구는 1907년 독일의 파울 에를리히(Paul Ehrlich)가 세포의 특정 조직이나 물질을 염색할 수 있는 강력한 결합력을 가진 화학물질이 염색된 조직이나 세포를 죽이는 것을 발견하면서 시작되었다. 비소 성분이 포함된 아톡실(Atoxyl) 이란 염색약을 쥐에 감염된 파동편모충 (Trypanosoma)이란 기생충을 염색하는 것을 발견하고, 이를 방법을 이용하여 기생충에 감염된 쥐를 치료하는 데 성공하였다.
세포나 병원균을 어떤 색소로 염색이 되면 그 색소로 병을 치료할 수 있다는 아주 큰 발견이었다. 비소가 포함된 아톡실 물질은 독성이 너무 강해서 사람한테 사용할 수 없어서 독성을 낮추는 안전한 개량작업을 605번이나 하였지만 모두 실패하였고, Ehrlich가 끈질긴 노력으로 606번째 실험에서 마침내 사람의 파동편모충을 치료할 수 있는 약을 개발할 수 있어서 “약품 606호(Compoud 606)”를 완성하였다. “약품 606호”는 매독 치료에도 치료 효과가 높다는 것을 발견하여 부작용이 많은 중금속인 수은 대신 “약품 606호”로 매독을 치료할 수 있게 되어서 당시 “마법의 탄알”이라고 불리기도 하였다.
이렇게 되어 명실상부한 최초의 항 미생물제인 606호로 명명된 살바르산((Salvarsan, 3,3‘-Diamino-4,4’-dihydroxy Arsenobenzen)이 널리 사용되었다. 당시 항생제란 말이 없어서 항 미생물 화학요법제로 사용되었지만, 매독균(Treponema pallidum)이란 나선(螺線)형의 코일 모양의 병원성 미생물을 죽이는 인간이 만든 최초의 항 미생물 제품임은 확실하지만, 상당히 비소 독성이 약해졌기는 하지만 여전히 비소가 포함되어 있어서 부작용이 있었다. 살바르산의 어원의 살 바르(Salvare)는 구원(救援)이란 의미로 보아서 그 당시 매독에 대한 폐해가 얼마나 컸는지를 짐작할 수 있다.
1934년 독일의 게하르트 도마크 (Gerhard Domagk)도 살바르산과 비슷하게 붉은 염색약인 “프론토실(Prontosil)”이 연쇄상 구균(Streptococcus pyogenes)이라는 용혈성(溶血性) 병원균에 감염되어 패혈증을 앓고 있는 쥐를 치료할 수 있다고 발견하면서 항 미생물제에 대해 본격적으로 연구를 하게 되었다.
사실 “프론토실”란 염료는 1932년 요세프 클라러(Josef Klarer)와 프리츠 미츠시(Fritz Mietzsch)가 이미 붉은색 염료로 합성하여 사용하고 있었다. 1936년 영국의 Colebrook와 Kenny가 아기를 출산하고 걸리는 산욕열 치료에 “프론토실”를 사용하여 산욕열로 인한 임산부 사망률을 급격히 감소시키면서 “프로토실”에 대한 관심이 커지게 되었다. “프론토실”은 생체 외(in vitro) 에서는 항 미생물 활성이 없지만, 생체 내로 흡수되면, 생체 내 항균 활성(in vivo)이 있는 이유를 1937년 Fuller가 “프론토실”이 생체 내에서 설파닐아마이드(Sulfanilamide)로 바뀌어 항균 활성이 있는 것을 밝히게 된다. 이후, 스위스의 Daniel Bovet는 설파닐아마이드를 직접 화학합성을 하였다.
한편, 초기 발견자인 Domagk는 연쇄상 구균에 감염돼 염증성 질병을 앓고 있던 그의 딸에게 “프론토실”로 완전히 치료한 결과를 1935년 처음 학회에 발표하였다. 설파닐아마이드는 포도상 구균, 연쇄상 구균에 대해서 치료 효과가 있고, 폐렴을 비롯한 세균성 질환을 치료할 수 있는 당시에 기적적인 치료 결과를 얻었다. 페니실린의 연구발표가 1929년 영국 실험병리학 저널(British Journal of Experimental Pathology)에 발표된 데 비해 “프론토실”은 1935년 발표되어 최초의 항생제란 영광은 받지 못했지만, 개발한 후 바로 사용되어서 병원균에 치료 효과가 인정되는 인류역사상 가장 먼저 시판된 항생제로는 기록되고 있다.
또한, 알렉산더 Fleming은 하워드 플로리( Haward Florey,)와 에른스트 체인( Ernst Chain) 공동으로 페니실린을 발견된 지 16년이 지난 1945년 노벨 생리의학상을 수상하였지만, 최초로 셀파닐아마드의 항 미생물 연구를 한 Domagk는 페니실린보다 6년 앞선 1939년 노벨 생리의학상의 수상자로 발표되지만, 당시 독일 나치 정권에 체포되어 나치가 노벨상 수상을 거부하여서, 2차 세계대전이 끝나고 나치 정권이 무너진 후, 처음 수상이 발표된 지 8년이나 지난 1947년에 상금이 없이 노벨상 메달만 수여받았다.
“프론토실” 유래 설파닐아미드는 효능을 높이기 위해 화학적 구조를 바꾸는 많은 합성 방법이 개발되어 1938년 폐렴에 최초로 효과가 있는 설파피리딘 (Sulfapyridine)을 만들었고, 이후 부작용을 줄인 설파티아졸 (Sulfathiazole), 설파디아진 (Sulfadiazine), 설파메톡사졸(Sulfamethoxazole), 설파세타마이드 (Sulfacetamide) 등으로 주로, 그람(Gram)양성 구균, 일부 그람(Gram)음성 구균, 그람(Gram)음성 간균(대장균, 티푸스균, 엔테로박터, 헤모필루스 인플레나, 클라미디아 등)에 효과가 있다고 발표되었다.
제2차 세계대전 중에는 설파계 항생제를 구급약으로 가지고 군인들이 전쟁 참가를 할 정도로 큰 공을 세우면서 설파제 항생제의 전성기가 된다. 하지만, 고체로 만든 설파제 알약은 먹기가 힘들어 1937년 미센질 (Massengill)이란 제약회사가 지금 자동차 부동액으로 사용하고 있는 디에틸렌 글리콜(Diethylene glycol)로 설파닐아미드를 녹여서 만든 물약을 동물 실험 없이 바로 출시하여 많은 사람이 사망하기 시작하였고, 특히, 358명의 어린이가 복용하였고, 105명이 콩팥독성으로 사망하는 대형 의료사고가 발생하였다.
대형 의료사고의 원인은 고체의 설파제를 녹인 용매인 디에틸렌 글리콜 때문이라고 밝혔지만, 엄청난 파장으로 설파제 항생물질의 관심이 점차 환자와 의사에게서 멀어지게 하였다.
결국, 물약을 만든 미센질 회사는 인수합병되어 사라졌고, 미국에서는 FDA 직원들이 일일이 설파제 물약을 수거해야 할 정도로 큰 의료사고로 보고되었다. 설파제 물약 의료사고는 1938년 미국 FDA에서는 엄격한 신약 허가 승인 잣대가 만드는 계기가 되었다.
주제와는 좀 다른 이야기이지만 독일에서 수면제로 만든 탈리도마이드(Thalidomide) 제가 1956년 세계로 보급된 후, 복용한 임산부가 사지 결손(Phocomelia)의 기형아를 출산하였고, 수면제를 복용한 사람 중 5,000~6,000명이 사망한 초대형 의료사고가 발생하였지만, 미국 FDA에서는 탈리도마이드의 제조 허가를 인가하지 않아서 탈리도마이드에 의해 의료피해를 보지 않았다. 이런 의료피해를 보지 않은 미국은 1938년의 FDA가 엄격한 의약품 제조 허가 덕분으로 생각하고, 탈리도마이드 사고 이후, FDA는 1961년 의약품 발매 전 시험을 한층 강화했다.
1937년 셀파닐아미드 물약의 의료사고가 일어난 시점과 비슷한 시기에, 푸른 곰팡이에서 발견된 페니실린이 상업적으로 대량생산이 가능하여 화학제인 설파제 대신 미생물 유래 페니실린으로 대체하는데 탄력을 받게 된다. 하지만, 더 많은 연구개발로 아직도 설파제는 여전히 화학 항생제로 사용되고 있다. 페니실린을 1929년 Fleming이 발견한 이후 정제, 화학구조, 대량생산 등에 많은 과학자의 노력으로 1940년 옥스퍼드병원에서 사람을 대상으로 한 치료에 성공하여 개발된 지 12년이나 지난 1941년에 실제로 상용화되었다.
페니실린 이후, 흙에 사는 미생물에서 신규 항생물질을 탐색하는데 일생을 바친 Selman A. Waksman이 10,000번 이상 흙에서 미생물을 분리하여 실험하다가 1943년 드디어 흙 미생물인 방선균에서 결핵에 효과가 있는 Streptomycin을 개발하였고, 1944년 폐결핵으로 죽어가는 젊은 여성 환자 생명을 구하는 것을 시작으로 전 세계 결핵으로 인한 사망을 극적으로 감소시키는 데 성공하였다. Waksman은 흙 속 곰팡이나 방선균에서 생성되어 다른 미생물인 병원균 성장을 억제하거나 죽이는 화학물질을 총칭하여 “Antibiotics”란 용어를 사용한 것이 “항생제”란 용어 사용이 시작되었다.
푸른곰팡이에서 최초로 항생물질인 Penicillin을 만든 Fleming과 흙 속 미생물인 방선균에서 결핵치료제 Streptomycin을 만든 Waksman의 노력 덕분에 수많은 사람의 생명을 구했고 각각 페니실린(Penicillin, β-lactam)계와 아미노당(Aminoglycoside)계의 항생제를 만드는 기본을 정립하였다. 1980년대까지는 주로 미생물에서 새로운 항생제를 탐색하였고, 1980년 이후는 화학구조를 바꾸는 반합성 항생제를 개발하여 현재까지 150여 가지 이상의 항생제가 발견되어 각종 병원균에 의한 질병을 치료할 수 있게 되었다.
<항생제의 종류와 기능>
신규항생제는 병원성 미생물이 살아가는 기능인 유전자 합성, 단백질 합성 등 DNA->RNA-> 단백질을 만드는 생명체의 Central dogma를 파괴하여 병원균을 죽이는 방법과 일부 병원균의 중요 구성물질 생합성을 억제하는 방법으로 항생제를 개발하였다. 구성물질 생합성 억제 방법으로는 엽산(Folic acid)합성을 방해하거나 세포벽 합성을 방해하여 병원균의 생체기능을 할 수 없게 하는 방법이다. 지금까지 개발된 항생물질의 개발 전략을 요약하면 <그림 1>과 같은 기전을 저해(沮害)하는 방법으로 항생제를 개발했다.
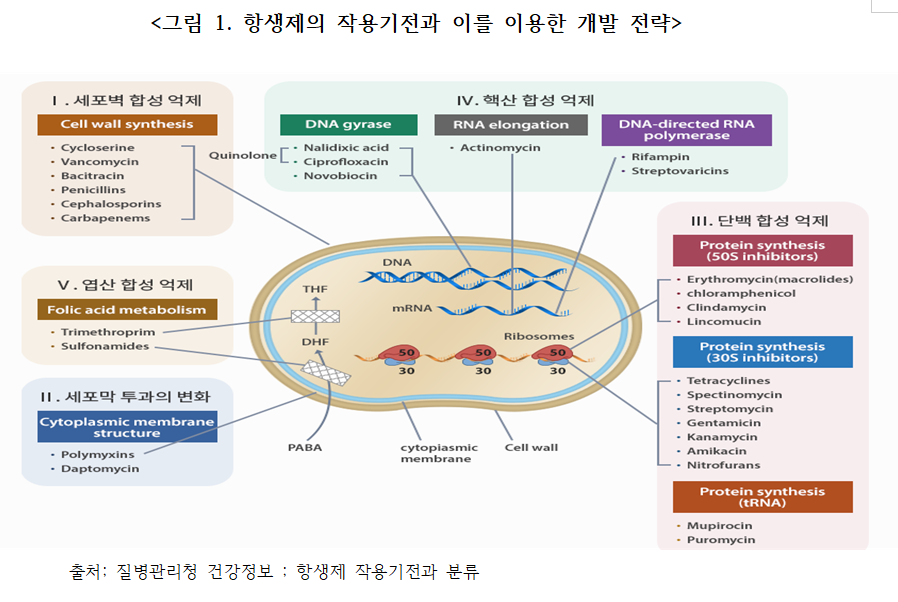
1) 세포벽 합성 억제 항생제
병원균은 세포벽으로 둘러싸여서 외부로부터 보호를 받고 있는데, 세포벽의 합성을 저해하면 보호벽이 파괴되어서 병원균이 죽게 되어 항균 효과를 가진다. 이런 기전으로 개발된 항생제의 대표적인 예가 베타락탐(β-lactam)계 항생제(Penicillin, Cephalosporin, Monobactam, Cabapenem등) <그림 2>와 Glycopeptide 항생제이다. 물론, 페니실린을 개발할 때는 베타락탐계 항생제를 미리 알고 개발한 것은 아니지만, 페니실린 개발을 표준으로 연구하였기 때문에 화학구조가 베타락탐 구조를 가진 항생제가 많이 개발되지 않았나 생각한다.
베타락탐계 항생제도 페니실린과 비슷한 페니실린(Penecillin)계, 세팔로스포린 (Cephalosporin)계, 모노박탐(Monobactam)계, 카바페넴(Cabapenem)계로 구분할 수 있다. 베타락탐계는 <그림 2>에 보는 바와 같이 질소와 카보닐(C=O)를 가진 4각형 구조에 페니실린은 황(S)을 포함한 5각형 구조를 세팔로스포린은 황과 카복실산(OOH)을 포함한 6각형 구조를 가졌고. 모노박탐의 사각형 락탐 구조에 황(SO3H)가 붙은 형태이고, 카바페넴은 질소와 카보닐(C=O)을 가진 4각형 락탐 구조에 5각형의 구조가 붙어있고 이 5각형 구조 내에 카복실산과 황(S)이 붙어있는 형태이다.
베타락탐계 항생제 중 페니실린의 4각형과 황을 포함한 5각형 구조 가진 페니실린계가 사용량이 증가함에 따라서 베타락탐 링(ring)을 파괴하는 β-lactamase 라는 효소를 만드는 병원균이 생겨서 베타락탐 링을 파괴하여 항생 능력을 잃게 함으로 항생제 내성이 생기기 시작했다. 점차 내성균의 범위가 넓어지면서 카바페넴계 항생제까지 분해할 수 있는 병원균이 창과 방패(矛盾) 원리에 따라 진화됨에 따라서 다제내성(多劑耐性) 항생제 내성 병원균의 발생이라는 심각한 문제를 만들었다.
또한 내성균을 막기 위해서 병원균의 베타락탐 분해효소를 비가역적으로 억제하는 클라블란산(Clavulanic acid), 설박탐(Sulbactam) 및 타조박탐(Tazobactam)등 베타락탐 분해효소 억제제는 항균력은 거의 없지만 베타락탐 분해효소에 의해 가수분해가 잘되는 베타락탐 항생제와 병합된 약제로 상품에 되어 사용되고 있다.
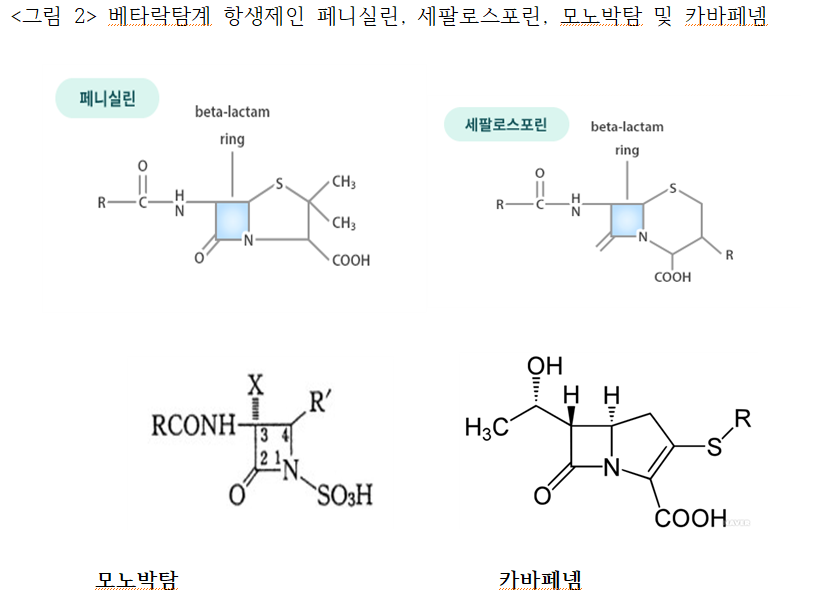
페니실린계 항생제의 일반 상품명으로 Penicillin G, Amoxicillin, Ampicillin, Piperacillin이 사용되는데 β-lactamase가 있어서 페니실린 저항성이 있는 병원균 치료에는 페니실린계와 병원균에 항균력은 없지만, β-lactamase 을 묶어 놓아 페니실린 저항성을 해제하는 클라블란산, 설박탐 및 타조박탐을 병용(倂用)하여 사용하는 Amoxicillin/Clavulanic acid, Ampicillin/Sulbactam, Piperacillin/Tazobactam 병합 제가 상품화되기도 한다.
2) 세포막 투과변화 항생제
세포막은 자기가 필요로 하는 물질을 선택적 능동수송을 하고 불필요 물질은 투과하지 못 하게 하여 세포 내/외의 고분자 물질이나 이온의 균질성을 만들어 항상성(恒常性, Homeobiosis)을 유지하여 생명현상을 유지하고 있다. 항생제가 병원균의 세포막을 변화시켜 항산성을 깨지면 결국 병원균이 사멸하게 된다. 대표적 세포막 투과변화 항생제는 polymyxin과 항진균제(amphotericin B, Ketoconazole, Fluconazole, Itraconazole 등)의 있고, 많이 사용할 시 인체 세포에서도 항산성을 깨트려 독성이 강해 사용에 주의가 필요하다.
3) 단백질 합성 억제 항생제
단백질은 병원균이 생존에 필요한 효소와 같은 기능성 단백질이 세포질 내에서 합성되어야만 한다. 단백질은 리보솜을 통해서 번역되는데, 병원균과 인체 세포의 리보솜 (Ribosome) 구성이 달라 병원균이 가진 리보솜만을 억제하여 기능단백질을 병원균이 만들지 못하여 병원균을 죽여서 항균 작용을 보이는 항생제들이 있다. Aminoglycosides, Tetracyclines, Macrolides, Lincosamides, Chloramphenicol 등이 해당된다.
4) 핵산합성 억제 항생제
병원균 증식에 필요한 과정인 DNA 복제와 전사, RNA 연결, RNA 생성을 방해하여 병원균이 증식할 수 없어서 항균 작용을 보이는 항생제들로서 대표적인 항생제로 Quinolone과 항결핵제로 사용되는 Rifampicin이 있다.
5) 엽산합성 억제 항생제
엽산은 핵산합성 시 꼭 필요한 물질이며, 인체와 병원균은 생존을 위하여 서로 다른 방식으로 엽산을 얻는다. 인체 세포는 엽산을 아예 생합성 할 수 없어서 섭취하는 음식물에서 얻어야만 하고, 병원균을 포함한 미생물은 자신이 스스로 생합성을 하여 사용한다. 병원균의 엽산 생합성 과정에 장애를 주면 핵산을 만들지 못하여 항균 활성을 나타내는데, 항생제로는 Sulfonamide와 Trimethoprim이 있다.
설파제 계통인 Sulfonamide는 미생물이 엽산을 합성할 때 사용하는 파라아미노벤조산 (para aminobezoic acid, PABA)와 비슷한 구조로 엽산합성 효소에 결합하여 떨어지지 않아서 엽산합성을 할 수 없게 하여 병원균을 죽게 한다. Trimethoprim 항생제는 Sulfonamide와는 다른 단계를 합성하는 효소를 억제하여 병용사용 시 항균 효과를 상승시키는 역할을 한다.
<맺는말>
항생제를 사용하기 이전 시대에 곪는 병인 황색포도상구균에 의한 균혈증 사망률은 82%이었고, 50대 이상 환자의 2%만 살아남을 수 있어서 항생물질의 발견과 개발은 인류 수명을 연장할 뿐만 아니라, 심각한 질병도 쉽게 고칠 수 있는 마법의 가루임은 틀림없는 사실이다.
지금까지 150종 이상의 항생제가 개발되어서 다양한 질병 치료에 쉽고 적절한 항생제를 선택하여 짧은 시간 내 치료가 가능하였다. 하지만, 창과 방패(矛盾)의 원리에 따라 병원균이 점차 사용하는 항생제에 내성을 만들어 사용 항생제로는 전혀 치료할 수 없게 만들어 병원균에 감염되면, 생명 위협을 받아도 전혀 손을 쓸 수 없어 마치 항생제가 개발되기 전인 1920년대 이전인 “Post-antibiotic era”로 돌아갈 수도 있다는 두려움을 느끼게 한다.
새로운 항생제 개발이 필요한데, 새로운 항생제가 시장에 출시되는데 5~10년의 연구개발과 5억~8억 US$이라는 막대한 개발비가 필요하다. 하지만, 항생제 내성으로 개발된 항생제의 시장수명이 길지 않을 뿐만 아니라 투입한 노력에 비해 경제적 대가가 너무 적어서 신약 개발은 제품수명이 긴 심혈관, 신경계, 항암제, 정신계 신약제 개발에 개발자의 관심이 높다.
하지만, 병원균의 설계도인 유전체가 많이 확보되어 있고, 현재 많이 활용되고 있는 유전자 편집 방법과 항생제 임상 사용 Big Data를 이용한 인공지능을 잘 활용하면 빠른 시간 내에 적은 비용으로 병원균의 새로운 방패를 뚫을 수 있는 새로운 창을 만드는 기술과 아울러 인체 내에 방패 보강도 할 수 있는 신약도 얼마든지 개발할 수 있다.
21세기에 들면서 바이러스에 의한 펜더믹은 우리의 생활 자체를 크게 바꾸고 있다. 감염 병원균에 대한 철저한 기초 및 임상 연구를 통해서 안전한 인류 생명을 보장받을 수 있는 새로운 해결책을 도출할 수 있을 것이다.
또한, 이미 잘 개발된 유전체(Genomics), 대사체(Metabolomics), 단백체 (Proteomics) 등에서 얻어진 Big Data를 근거로 인공지능으로 각 지식에 대한 상관관계를 구축하는 연결체 (Connectomics) 등이 완벽하게 이해하게 된다면, 항생제 내성을 극복할 수 있는 새로운 기전의 항생물질은 물론 새로운 또는 기존 기전의 항생제에 대해 병원균이 만들 수 있는 방패인 항생제 내성 기전을 예측하여 대응책을 만드는 방안도 가능할 것이다.
하지만, 우리가 먼저 실천해야 할 일은 항생제 내성이 생기지 않게 올바른 항생제 사용방안의 구축과 실천이 무엇보다 중요하다고 생각한다.
- 기사입력 2022년06월07일 17시00분
- 검색어 태그 1
댓글목록
등록된 댓글이 없습니다.
